|
|
|
1.6 HİDROJEN ATOMU VE BOHR MODELİ
İngiliz fizikçisi J.J. Thomson elektronları, üzümlü kekteki üzüm taneleri gibi,
sürekli artı yük dağılımı içine gömülmüş eksi yüklü tanecikler olarak ele alarak
bir atom modeli geliştirmişti. E. Rutherfordun yaptığı, ![]() parçacıklarının metal plakalardan saçılma deneylerinin sonucu bu model
yardımıyla açıklanamadı. Kendi kuramsal açıklamalarına dayanarak 1911de
Rutherfordun geliştirdiği başka bir atom modeli ön plana çıktı. Rutherford atom
modelinde, atomun tüm artı yükü ve hemen hemen tüm kütlesi atomun çekirdeği
denilen, atomun boyutuna göre çok küçük bir bölgede yoğunlaşmıştır. Çekirdek
tarafından
parçacıklarının metal plakalardan saçılma deneylerinin sonucu bu model
yardımıyla açıklanamadı. Kendi kuramsal açıklamalarına dayanarak 1911de
Rutherfordun geliştirdiği başka bir atom modeli ön plana çıktı. Rutherford atom
modelinde, atomun tüm artı yükü ve hemen hemen tüm kütlesi atomun çekirdeği
denilen, atomun boyutuna göre çok küçük bir bölgede yoğunlaşmıştır. Çekirdek
tarafından ![]() ile orantılı bir kuvvet ile çekilen
elektronlar ise, çekirdek tarafında tıpkı gezegenler gibi kendi yörüngelerinde
dolanırlar.
ile orantılı bir kuvvet ile çekilen
elektronlar ise, çekirdek tarafında tıpkı gezegenler gibi kendi yörüngelerinde
dolanırlar.
![]() parçacıklarının atomlardan saçılmalarını nicel olarak
iyi açıklamasına karşın Rutherford atom modelinin klasik fizik açısından
giderilemeyen iki önemli güçlüğü vardı. Bunlar; (i) atomların kararlılığı ve
(ii) atom spektrumlarının kesikliğinin açıklanamamasıydı. Rutherford modelinde
elektronlar eğrisel yörüngelerinde ivmeli hareket yapan her yüklü parçacık gibi
ışık yayarak enerji kaybetmelidirler. Enerjileri azalan elektronların
yörünge yarıçapları giderek küçüleceği için
bunlar sonunda çekirdeğin üstüne çökmelidirler. Klasik fizik yasalarına göre bu
çöküş
parçacıklarının atomlardan saçılmalarını nicel olarak
iyi açıklamasına karşın Rutherford atom modelinin klasik fizik açısından
giderilemeyen iki önemli güçlüğü vardı. Bunlar; (i) atomların kararlılığı ve
(ii) atom spektrumlarının kesikliğinin açıklanamamasıydı. Rutherford modelinde
elektronlar eğrisel yörüngelerinde ivmeli hareket yapan her yüklü parçacık gibi
ışık yayarak enerji kaybetmelidirler. Enerjileri azalan elektronların
yörünge yarıçapları giderek küçüleceği için
bunlar sonunda çekirdeğin üstüne çökmelidirler. Klasik fizik yasalarına göre bu
çöküş ![]() saniye gibi kısa bir sürede olur. Bu modele göre bütün
atomlar kararsızdır. Bu ise açıkça bir çelişkidir, çünkü çevremizde atomlardan
yapılmış herşey kararlı bir yapıdadır.
saniye gibi kısa bir sürede olur. Bu modele göre bütün
atomlar kararsızdır. Bu ise açıkça bir çelişkidir, çünkü çevremizde atomlardan
yapılmış herşey kararlı bir yapıdadır.
Yukarıda değinilen ikinci güçlük ise şu idi: ivmeli hareket eden elektronların yayacağı ışınım frekansı dolanım frekansıdır. Elektronun çöküşü esnasında yarıçaplı bir spiral üzerinde sürekli azaldığından dolanım frekansı, dolayısı ile yapacağı ışınımın frekansı da sürekli şekilde değişmeli idi. Halbuki akkor haldeki gazların (gazı oluşturan atomun yapısına bağlı olarak) belirli renklerde kesikli spektruma sahip ışıma yaptıkları 18. Yüzyıldan beri bilinmekte idi. Örneğin hidrojen atomunun görünür bölgede ışıdığı renklerin dalgaboylarının ampirik olarak,
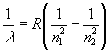 |
(1.33) |
şeklinde bir bağıntı ile ifade edilebileceği 1885te J.J. Balmer tarafından bulunmuştu. Burada
Rutherford atom modelinin ortaya atılışından iki yıl sonra Niels Bohr 1913te atomların ışıma spektrumlarının kesikliliğini ve kısmen de kararlılığını açıklayan iki varsayım ileri sürdü. Bohr varsayımları olarak bilinen bu varsayımlar şunlardır:
| (1.34) |
şeklinde kuantumludur. Böyle bir elektron bulunduğu yörüngede ışıma yapmadan dolanır. (1.34) bağıntısına Bohr kuantumlama koş
ulu denir.ii. Bir elektron izinli yörüngeler arasında ani geçişler yapabilir ve bu yörüngelerin
enerji farkı,
| (1.35) |
frekanslı bir ışıma olarak ortaya çıkar. Atomlar, elektronlarını daha yüksek enerjili yörüngelere çıkaracak şekilde enerji soğururken de yine (1.35) bağıntısına uyarlar.
Bohr varsayımlarının sonuçlarını görmek için bunları hidrojene benzeyen tek elektronlu bir atoma uygulayalım ve basit olması için elektronun
| (1.36) |
yazılabilir. Çembersel yörünge
için açısal momentum ![]() şeklindedir. Bohr kuantumlama koşulunu
kullanarak
şeklindedir. Bohr kuantumlama koşulunu
kullanarak ![]() ve buradan bulunan
ve buradan bulunan ![]() ifadesini (1.36) da yerine koyarsak
ifadesini (1.36) da yerine koyarsak ![]() yörünge yarıçaplarının
yörünge yarıçaplarının
| (1.37) | |
şeklinde kuantumlanmış olduğunu görürüz. Burada
| (1.38) |
uzunluğuna hidrojenin bohr yarıçapı denir. (1.37) ifadesini
| (1.39) | |
şeklinde kuantumlanmış olduğunu görürüz. Burada
| (1.40) |
sabitine ince yapı sabiti adı verilir. Artık (1.37) ve (1.39) bağıntılarından yararlanarak elektronun
| (1.41) |
toplam enerjisinin
| (1.42) | |
şeklinde kuantumlanmış olduğunu göstermek zor değildir. (1.42)de son eşitliği yazarken elektronun durgun enerjisi için
(1.42) bağıntısı ile ifade edilen enerjilere hidrojenin enerji düzeyleri denir. En düşük enerji düzeyi,
Hidrojenin ışıma spektrumunun kesikliliği artık kolayca ifade edilebilecektir. Atom uyarılmış bir düzeyden daha düşük bir enerji durumuna geçerken aradaki enerji farkına eşit enerjili bir foton yayar. Buna göre
| (1.43) | |
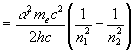 |
şeklinde ifade edilebilir. Böylece ![]() atomunun bütün serileri elde
edilirken, deneysel olarak ölçülen
atomunun bütün serileri elde
edilirken, deneysel olarak ölçülen ![]() Rydberg sabitinin de
Rydberg sabitinin de
| (1.44) | |
şeklinde temel doğa sabitleri cinsinden bir ifadesi elde edilmiş olur.
Atomların kararlılığı için ise şu açıklama getirilmiştir. En düşük izinli enerji düzeyi
Hidrojen atomunda çembersel yörüngelerde dolanan elektron için kolayca
uygulanabilen Bohr kuantumlamakoşulu, eliptik
yörüngelere ve diğer periyodik hareketlere de uygulanabilecek şekilde Sommerfeld
ve Wilson tarafından genelleştirildi. Bunu ifade edebilmek için ![]() kanonik koordinatlarına sahip
kanonik koordinatlarına sahip ![]() serbestlik dereceli bir sistemi gözönüne alalım. Her periyodik
serbestlik dereceli bir sistemi gözönüne alalım. Her periyodik ![]() kanonik çifti için yazılan, faz uzayındaki
kanonik çifti için yazılan, faz uzayındaki ![]() integrali eylem (yani açısal momentumun)boyutunda bir
nicelik olup burada integral
integrali eylem (yani açısal momentumun)boyutunda bir
nicelik olup burada integral ![]() nin
faz uzayındaki bir tam devri üzerindedir. Buna göre Sommerfeld-Wilson
kuantumlama koşulu şöyle yazılır:
nin
faz uzayındaki bir tam devri üzerindedir. Buna göre Sommerfeld-Wilson
kuantumlama koşulu şöyle yazılır:
| (1.45) |
Bu yeni kuantumlama koşulu
Bohr modelinde elektronlar klasik noktasal parçacıklar olarak ele alınır. 1924te de Broglie,
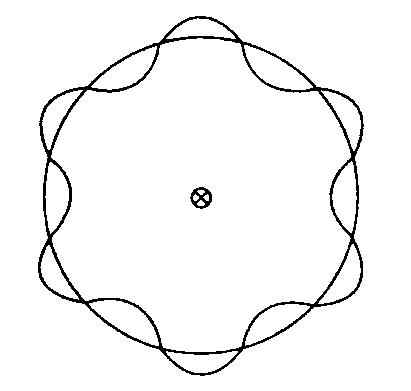
Şekil 1.6. Elektronun dolandığı yörüngenin çevresinin de Broglie dalga boyunun
tamsayı katı olması ![]() Bohr
kuantumlanma koşuluna denktir.
Bohr
kuantumlanma koşuluna denktir.